Om opdagelsen af GLP-1 og erkendelsen af virkningerne på metabolisme og fødeindtagelse.
Artiklen har været bragt i Dansk Kemi nr. 6, 2024 og kan læses uden illustrationer, strukturer og ligninger herunder.
Af Jens Juul Holst1,2 og Frederike Sass1,3
1 Novo Nordisk Foundation Center for Basic Metabolic Research, Københavns Universitet
2 Biomedicinsk Institut, Panum Instituttet, Det Sundhedsvidenskabelige Fakultet, Københavns Universitet
3 Center for Adipocyte Signaling (ADIPOSIGN), Syddansk Universitet, Odense
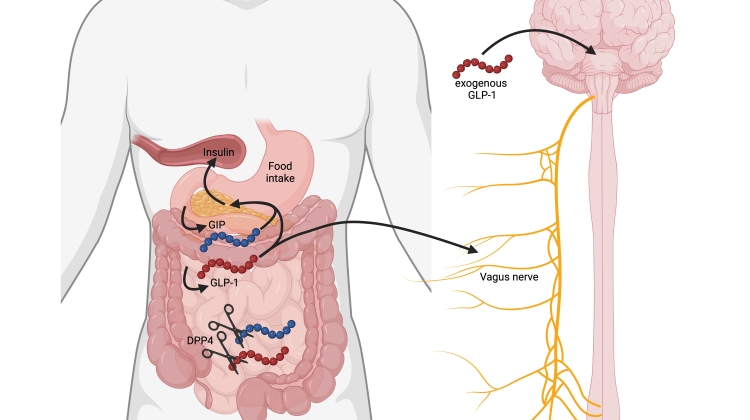
GLP-1 er et peptid-hormon på 30 aminosyrer, som frigives fra kirtelceller i tarmslimhinden i forbindelse med måltidsindtagelse. Det har vist sig at spille en rolle for blodsukkerreguleringen, men har også effekt på mæthedsfølelse og fødeindtagelse, og disse effekter kan i dag udnyttes i form af langtidsvirkende analoger af hormonet, som er sensationelt effektive, dels hvad angår reguleringen af stofskiftet ved type 2 sukkersyge og dels med hensyn til at fremkalde vægttab hos svært overvægtige. I forbindelse hermed nedsættes risikoen for udvikling eller forværring af hjerte-kar-sygdomme, nyreskader og kognitive problemer. Der er derfor tale om et af de største fremskridt nogensinde inden for behandlingen af disse sygdomme. Men hvor kommer hormonet fra?
Patienter med for lavt blodsukker ledte til de første spor af et vigtigt inkretinhormon
Hormonet blev beskrevet første gang i 1986 [1,2]. Baggrunden var et ønske om at forstå, hvorfor nogen patienter, som blev opereret for mavesårssygdom, der var et stort problem i 1970’erne, udviklede hypoglykæmi, dvs. for lavt blodsukker, efter indtag af et måltid. Hypoglykæmien skyldtes klart en overdrevet insulin-sekretion, og eftersom det skete ved måltiderne, kunne det måske skyldes et inkretinhormon, dvs. hormoner fra tarmen, som netop stimulerer insulinsekretionen i forbindelse med måltider [3]. Men hvilket hormon?
Der eksisterede nogle endokrine celler i tarmslimhinden, som kunne farves med antistoffer mod hormonet glukagon [4], som ellers bliver dannet ved siden af insulin i de langerhanske øer i bugspytkirtlen, og glukagon kunne stimulere insulinsekretionen, vidste man. Det viste sig hurtigt med immunkemiske metoder, at den glukagon-lignende forbindelse, der var i tarmen, ikke kunne være rigtigt glukagon. Men hvad var det så?
Forbindelsen kunne følges under ekstraktion og oprensning ved hjælp af radioimmunologiske metoder (jf. antistoffernes reaktion), hvilket førte til opklaringen: det stof, der var ansvarligt for immunreaktionen, var glicentin. Et peptid på 69 aminosyrer, som indeholdt hele glukagon-sekvensen, men som var forlænget med flere aminosyrer i begge ender [5,6]. Ved hjælp af studier på bugspytkirtler isoleret fra grise, blev det fastlagt, at stoffet ingen virkning havde på insulinsekretionen [7]. Men yderligere undersøgelser viste, at glicentin formentlig repræsenterede et forstadium for hormonet glukagon [8]. På daværende tidspunkt fik hormonforstadier meget opmærksomhed – det var lige vist, at alle peptidhormoner dannes fra større forstadier, og at forstadierne muligvis kunne give ophav til mere end ét biologisk aktivt produkt [9]. I tilfældet glicentin ville dette blive kløvet differentielt og således give ophav til glukagon i bugspytkirtlen og til glicentin (og et fragment) i tarmslimhinden [10]. Imidlertid viste yderligere forsøg, at glukagonforstadiet måtte være større end de 69 aminosyrer i glicentin, formentlig 160-180 aminosyrer (som vist i forsøg med såkaldt cellefri translation) [11]. Hvad kunne der være i resten?
Forstadiemolekylet blev identificeret og dernæst GLP-1
På den tid holdt molekylærbiologien sit indtog, og i 1983 lykkedes det en amerikansk molekylærbiolog, på basis af mRNA fra langerhanske øer fra 400 hamstere at klone det første glukagon-forstadie fra et pattedyr [12]. Den komplementære DNA-sekvens, som svarede til 160 aminosyrer, viste ganske rigtigt, at glicentin udgjorde den ene halvdel af forstadiemolekylet, men i den anden befandt der sig hele to glucagon-lignende sekvenser, der var indrammet af basiske aminosyrer, som man vidste, ville være potentielle kløvningssteder.
Disse sekvenser blev snart syntetiseret og der blev udviklet radioimmunanalyser for hvert af dem [13]. Stoffernes skæbne i organismen kunne derfor følges. Det viste sig, at også denne del af forstadiet bliver behandlet forskelligt i tarm og bugspytkirtel [14]. I bugspytkirtlen forbliver hele resten af forstadiet med de to glukagonlignende sekvenser samlet som et stort peptid (Major Proglucagon Fragment), mens begge de to sekvenser tilsyneladende bliver frigjort i tarmen. Det kunne endvidere vises på levende præparationer af henholdsvis tarm og bugspytkirtel fra gris, at de to sekvenser også bliver udskilt ved passende stimulation [14]. Men ingen af de to peptider havde nogen virkning på insulinsekretionen fra bugspytkirtlen.
Det blev derfor besluttet at isolere og renfremstille de to peptider fra ekstrakter af menneske- og grise-tarm, og nu viste det sig, at det ene af de glukagon-lignende peptider (GLP-1) særdeles effektivt og potent stimulerede insulinsekretion [2]. Sekvensanalyse af det renfremstillede peptid viste, at peptidet var seks aminosyrer kortere end det forudsagte, og desuden var amideret C-terminalt [2,15]. Hormonet betegnes derfor i dag GLP-1 (7-36)amid. Radioimmunanalyserne viste, at (begge) de glukagonlignende hormoner kunne findes i den humane blodcirkulation og bliver frigivet i forbindelse med indtag af et måltid [13], og GLP-1 kunne forklare en del af den måltidsrelaterede insulinsekretion, den såkaldte inkretinvirkning [16]. Senere forsøg med GLP-1 receptor antagonister viste desuden, at det faktisk var GLP-1, der var ansvarligt for hypoglykæmien hos de mavesårsopererede patienter [17].
Udviklingen af medicinske applikationer baseret på DPP-4 hæmmere
Alt dette var ny og banebrydende fysiologisk indsigt, men ville det også have klinisk interesse? En virkning på sukkersyge forekom usandsynlig, fordi insulincellerne var syge hos disse patienter; et andet insulinfrigørende hormon, GIP, havde ingen virkning [18] og patienterne så ud til at have mistet inkretinvirkningen [19]. På den anden side viste forsøgene på den isolerede bugspytkirtel, at GLP-1 også hæmmede glukagonsekretionen [20], som er forøget hos diabetespatienter og bidrager til det forøgede blodsukker, så måske alligevel?
Videre forsøg viste, at hormonet også havde kraftig virkning på mavesækstømning og de øvrige bevægelser i mave-tarm-kanalen såvel som på sekretion af mavesyre og bugspyt [21]. På den tid var man begyndt at interessere sig for tarmens betydning for regulering af fødeindtagelse, og det viste sig, at GLP-1 dosis-afhængigt kunne hæmme appetit og fødeindtagelse hos mennesker [22]. Alt dette var lovende i forbindelse med type 2 diabetes, og i 1993 fik en gruppe patienter med ret fremskreden diabetes en opløsning af GLP-1 injiceret direkte i en blodåre. Det viste sig, at deres blodsukker, som var meget højt, blev fuldstændig normaliseret i løbet af fire timer [23]. Det var et stort øjeblik.
Nu fulgte arbejdet med at ”oversætte” denne virkning til praktisk klinik. Det blev forsøgt med indsprøjtninger under huden, men det fungerede ikke rigtigt, for virkningen var ringe og kortvarig, og gav man for meget stof, fik patienterne kvalme og kastede op [24]. Det viste sig, at hormonet i løbet af få minutter bliver nedbrudt af et enzym, DPP-4 (dipeptidyl peptidase-4) [25]. Men det kunne vises, at hvis man hæmmede enzymet, ville kroppens eget GLP-1 hormon overleve længere og derfor virke bedre [26,27], og dette blev starten på udviklingen af DPP-4 hæmmerne (sitagliptin, Januvia) til diabetesbehandling, som blev en verdensomspændende succes og stadig bruges i vidt omfang.
Den seneste udvikling med revolutionerede effekter på vægttab
Man kunne jo også prøve at stabilisere GLP-1 hormonet, og her kommer Novo Nordisk ind i billedet. I Bagsværd havde man erfaring med at stabilisere insulin-molekylet ved acylering, tilhæftning af en fedtsyre. Herved binder det acylerede molekyle til albumin i blodet og er så beskyttet mod både enzymer og eliminering i nyrerne. Tricket virkede og hermed opstod liraglutide [28], som kun behøvede en enkelt daglig injektion og som både havde god virkning på blodsukkeret og fremkaldte et vist vægttab [29]. Gennem omhyggelige dosisvirkningsforsøg med forsigtig optitrering (hvormed bivirkningerne i et vist omfang kunne undgås), kunne man vise, at vægttabet kunne forøges med højere doser [30], og dette blev indledningen på godkendelsen af liraglutide 3,0 mg (Saxenda) til fedmebehandling [31].
Den internationale udvikling på området nødvendiggjorde imidlertid udvikling af GLP-1 agonister med forlænget virkningsvarighed, og et resultat af bestræbelserne herpå blev semaglutid (Ozempic), som nu kunne gives én gang ugentligt med endnu bedre resultater, hvad angår blodsukker og vægtreduktion [28]. En yderligere udvikling inden for fedmebehandling krævede imidlertid endnu flere omhyggelige dosisresponsstudier, og et sådant viste, at med endnu højere doser kunne et endnu større vægttab opnås, nemlig 14 procent med 0,4 mg dagligt over et år (daglig indgift af små doser blev valgt for at hindre bivirkninger) [32]. Dette lagde fundamentet til STEP-forsøgene med 2,4 mg semaglutide (nu Wegovy), hvor man kunne opnå op til 18 procent vægttab i løbet af 68 uger (hvoraf de første 20 uger er optitrering) hos overvægtige, som ikke havde diabetes [33].
Wegovy blev herefter godkendt til fedmebehandling. Udviklingen er ikke standset her – hos Eli Lilly i USA har man haft held med at udvikle en GIP-GLP-1 co-agonist, tirzepatide (Mounjaro), som er endnu mere effektiv end Wegovy (26 procent vægttab på 88 uger) [34], og flere andre produkter er på vej, for eksempel hos Novo Nordisk, hvor der fokuseres på en kombination eller co-agonist for GLP-1 receptoren og amylin-receptoren (”cagrisema” eller ”amycretin”) [35], som ser ud til at resultere i endnu større vægttab.
Med disse stoffer er det med andre ord muligt at opnå vægttab af samme størrelsesorden, som det ses efter fedmekirurgi, og GLP-1 agonisterne vil utvivlsomt ændre behandlingen af overvægt og type 2 diabetes i fremtiden.
E-mail:
Jens Juul Holst: jjholst@sund.ku.dk
Referencer
1. Holst JJ, Orskov C, Schwartz TW, Buhl T, Baldissera F. Proglucagon 78-107, a potent insulinotropic hormone from the lower small intestine. Diabetologia. 1986;29:549A-A.
2. Holst JJ, Orskov C, Nielsen OV, Schwartz TW. Truncated glucagon-like peptide I, an insulin-releasing hormone from the distal gut. FEBS Lett. 1987;211(2):169-74.
3. Rehfeld JF, Heding LG, Holst JJ. Increased gut glucagon release as pathogenetic factor in reactive hypoglycaemia? Lancet. 1973;1(795):116-8.
4. Holst JJ. Extrapancreatic glucagons. Digestion. 1978;17(2):168-90.
5. Holst JJ. Evidence that glicentin contains the entire sequence of glucagon. Biochem J. 1980;187(2):337-43.
6. Thim L, Moody AJ. The primary structure of porcine glicentin (proglucagon). Regul Pept. 1981;2(2):139-50.
7. Jensen SL, Kuhl C, Nielsen OV, Holst JJ. Isolation and perfusion of the porcine pancreas. Scand J Gastroenterol Suppl. 1976;37:57-61.
8. Moody AJ, Holst JJ, Thim L, Jensen SL. Relationship of glicentin to proglucagon and glucagon in the porcine pancreas. Nature. 1981;289(5797):514-6.
9. Steiner DF, Patzelt C, Chan SJ, Quinn PS, Tager HS, Nielsen D, et al. Formation of biologically active peptides. Proc R Soc Lond B Biol Sci. 1980;210(1178):45-59.
10. Holst JJ. Gut glucagon, enteroglucagon, gut glucagonlike immunoreactivity, glicentin–current status. Gastroenterology. 1983;84(6):1602-13.
11. Patzelt C, Schug G. The major proglucagon fragment: an abundant islet protein and secretory product. FEBS Lett. 1981;129(1):127-30.
12. Bell GI, Santerre RF, Mullenbach GT. Hamster preproglucagon contains the sequence of glucagon and two related peptides. Nature. 1983;302(5910):716-8.
13. Orskov C, Holst JJ. Radio-immunoassays for glucagon-like peptides 1 and 2 (GLP-1 and GLP-2). Scand J Clin Lab Invest. 1987;47(2):165-74.
14. Orskov C, Holst JJ, Knuhtsen S, Baldissera FG, Poulsen SS, Nielsen OV. Glucagon-like peptides GLP-1 and GLP-2, predicted products of the glucagon gene, are secreted separately from pig small intestine but not pancreas. Endocrinology. 1986;119(4):1467-75.
15. Orskov C, Bersani M, Johnsen AH, Hojrup P, Holst JJ. Complete sequences of glucagon-like peptide-1 from human and pig small intestine. J Biol Chem. 1989;264(22):12826-9.
16. Kreymann B, Williams G, Ghatei MA, Bloom SR. Glucagon-like peptide-1 7-36: a physiological incretin in man. Lancet. 1987;2(8571):1300-4.
17. Craig CM, Liu LF, Deacon CF, Holst JJ, McLaughlin TL. Critical role for GLP-1 in symptomatic post-bariatric hypoglycaemia. Diabetologia. 2016.
18. Krarup T, Saurbrey N, Moody AJ, Kuhl C, Madsbad S. Effect of porcine gastric inhibitory polypeptide on beta-cell function in type I and type II diabetes mellitus. Metabolism. 1987;36(7):677-82.
19. Nauck M, Stockmann F, Ebert R, Creutzfeldt W. Reduced incretin effect in type 2 (non-insulin-dependent) diabetes. Diabetologia. 1986;29(1):46-52.
20. Orskov C, Nielsen JH. Truncated glucagon-like peptide-1 (proglucagon 78-107 amide), an intestinal insulin-releasing peptide, has specific receptors on rat insulinoma cells (RIN 5AH). FEBS Lett. 1988;229(1):175-8.
21. Holst JJ. Glucagon-like Peptide 1(GLP-1): an intestinal hormone signalling nutritional abundance, with an unusual therapeutic potential. Trends Endocrinol Metab. 1999;10(6):229-34.
22. Flint A, Raben A, Astrup A, Holst JJ. Glucagon-like Peptide 1 Promotes Satiety and Suppresses Energy Intake in Humans. J Clin Invest. 1998;101(3):515-20.
23. Nauck MA, Kleine N, Orskov C, Holst JJ, Willms B, Creutzfeldt W. Normalization of fasting hyperglycaemia by exogenous glucagon- like peptide 1 (7-36 amide) in type 2 (non-insulin-dependent) diabetic patients. Diabetologia. 1993;36(8):741-4.
24. Ritzel R, Orskov C, Holst JJ, Nauck MA. Pharmacokinetic, insulinotropic, and glucagonostatic properties of GLP-1 [7-36 amide] after subcutaneous injection in healthy volunteers. Dose-response-relationships. Diabetologia. 1995;38(6):720-5.
25. Deacon CF, Johnsen AH, Holst JJ. Degradation of glucagon-like peptide-1 by human plasma in vitro yields an N-terminally truncated peptide that is a major endogenous metabolite in vivo. J Clin Endocrinol Metab. 1995;80(3):952-7.
26. Deacon CF, Nauck MA, Toft-Nielsen M, Pridal L, Willms B, Holst JJ. Both subcutaneously and intravenously administered glucagon-like peptide I are rapidly degraded from the NH2-terminus in type II diabetic patients and in healthy subjects. Diabetes. 1995;44(9):1126-31.
27. Holst JJ, Deacon CF. Inhibition of the activity of dipeptidyl-peptidase IV as a treatment for type 2 diabetes. Diabetes. 1998;47(11):1663-70.
28. Knudsen LB, Lau J. The Discovery and Development of Liraglutide and Semaglutide. Front Endocrinol (Lausanne). 2019;10:155.
29. Marso SP, Daniels GH, Brown-Frandsen K, Kristensen P, Mann JF, Nauck MA, et al. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2016;375(4):311-22.
30. Astrup A, Rossner S, Van GL, Rissanen A, Niskanen L, Al HM, et al. Effects of liraglutide in the treatment of obesity: a randomised, double-blind, placebo-controlled study. Lancet. 2009;374(9701):1606-16.
31. Pi-Sunyer X, Astrup A, Fujioka K, Greenway F, Halpern A, Krempf M, et al. A Randomized, Controlled Trial of 3.0 mg of Liraglutide in Weight Management. N Engl J Med. 2015;373(1):11-22.
32. O’Neil PM, Birkenfeld AL, McGowan B, Mosenzon O, Pedersen SD, Wharton S, et al. Efficacy and safety of semaglutide compared with liraglutide and placebo for weight loss in patients with obesity: a randomised, double-blind, placebo and active controlled, dose-ranging, phase 2 trial. Lancet. 2018;392(10148):637-49.
33. Wilding JPH, Batterham RL, Calanna S, Davies M, Van Gaal LF, Lingvay I, et al. Once-Weekly Semaglutide in Adults with Overweight or Obesity. N Engl J Med. 2021;384(11):989.
34. Aronne LJ, Sattar N, Horn DB, Bays HE, Wharton S, Lin WY, et al. Continued Treatment With Tirzepatide for Maintenance of Weight Reduction in Adults With Obesity: The SURMOUNT-4 Randomized Clinical Trial. JAMA. 2024;331(1):38-48.
35. Frias JP, Deenadayalan S, Erichsen L, Knop FK, Lingvay I, Macura S, et al. Efficacy and safety of co-administered once-weekly cagrilintide 2.4 mg with once-weekly semaglutide 2.4 mg in type 2 diabetes: a multicentre, randomised, double-blind, active-controlled, phase 2 trial. Lancet. 2023;402(10403):720-30.
BOKS:
De langerhanske øer er bugspytkirtlens endokrine væv, der er distribueret som små øer i det exokrine væv. De langerhanske øer består af fire forskellige slags celler:
• betaceller, som producerer insulin (50-80 procent).
• alfaceller, som producerer glykagon (15-20 procent).
• deltaceller, som producerer somatostatin (3-10 procent).
• PP-celler, som producerer pankreatisk polypeptid (1 procent).
BOKS:
Radioimmunologisk metode, radioimmunanalyse, er en sensitiv og specifik teknik til måling af tilstedeværelse og koncentration af et antistof eller et antigen, for eksempel hormoner. Radioimmunologiske metoder har meget høj sensitivitet. I nogle systemer kan man måle koncentrationer så lave som 10-14 mol/l. Også specificiteten er usædvanlig høj.
“Opdagelser bag Novo Nordisks slankemedicin Wegovy kom ikke fra et laboratorium i udlandet. Det var grundforskning ledet af professor Jens Juul Holst på Københavns Universitet, der lå til grund. Ingen kunne forestille sig, at Holsts opdagelse fra 1986 af et basalt tarmhormon, GLP-1, engang i fremtiden ville være en væsentlig grund til, at Danmark i disse dage er i økonomisk vækst”.
Citat fra professor Jesper Svejstrup, leder af Center for Gene Expression (CGEN), Københavns Universitet, bragt i Weekendavisen den 30. august 2024.

